Exosomas derivados de células madre mesenquimales: Oportunidades y desafíos
Lin Cheng,1 Kun Zhang,2Shuying Wu,1Manhua Cui,1 and Tianmin Xu1
1Departamento de Ginecología y Oncología del Segundo Hospital de la Universidad de Jilin, Ziqiang Street 218, Changchun 130000, China
2entro de Investigación Médica, Second Clinical College, Universidad de Jilin, Ziqiang Street 218, Changchun 130000, China
Las células madre mesenquimales han estado a la vanguardia de la medicina regenerativa durante muchos años. Se ha reportado recientemente que los exosomas son nano vesículas involucradas en la comunicación intercelular y el transporte de material genético que pueden ser liberados por las células madre mesenquimales, desempeñan un papel en la terapia celular de muchas enfermedades, como el infarto de miocardio, la adicción a las drogas y estado epiléptico. También se cree que ayudan a mejorar la lesión cerebral prematura inducida por la inflamación, la lesión hepática y varios tipos de cáncer.
Esta reseña destaca los avances recientes en la exploración de exosomas derivados de células madre mesenquimales en aplicaciones terapéuticas. También se analizan los contenidos naturales, la potencia de administración de fármacos, los métodos de modificación y los métodos de carga de fármacos de los exosomas.

Introducción
Las células madre mesenquimales (MSC, por sus siglas en inglés) se originan en el mesodermo de muchos tejidos, entre ellos la médula ósea, el hígado, el bazo, la sangre periférica, el tejido adiposo, la placenta y el cordón umbilical, y tienen la capacidad de auto-regenerarse y la capacidad de generar células diferenciadas. En la última década, las MSC se han convertido en un tema de investigación popular debido a su posible papel en la medicina regenerativa, inmunorregulación, neuroprotección y efectos antitumorales atribuidos originalmente al reemplazo directo de células.
Sin embargo, los datos experimentales indican que la mayoría de las MSC se eliminan en gran medida, mientras que una pequeña proporción se integrará en el tejido lesionado después de la inyección intravenosa [1].
Además, la “teoría del reemplazo celular” no tiene en cuenta la duración suficiente en una variedad de modelos de enfermedades [2, 3]. Recientemente, se han presentado varios mecanismos con respecto al potencial terapéutico de las MSC, incluyendo (1) factores paracrinos que involucran proteínas / péptidos y hormonas y (2) la transferencia de mitocondrias o exosomas / microvesículas que empaquetan moléculas multitudinarias [4].
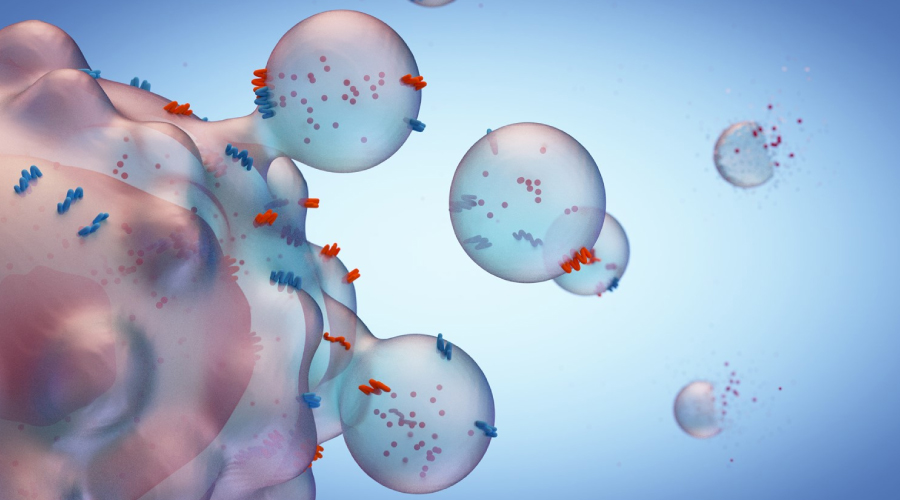
Los exosomas son una familia de nano partículas con un diámetro en el rango de 40 a 100 nm que se generan dentro de los endosomas multivesiculares o cuerpos multivesiculares (MVB) y se secretan cuando estos compartimentos se fusionan con la membrana plasmática [5]. Los exosomas están enriquecidos en componentes derivados del endosoma, así como en muchas moléculas bioactivas como proteínas, lípidos, ARNm, microARN (miARN), ARN largos no codificantes (ARNnc), ARN de transferencia (ARNt), ADN genómico, ADNc y ADN mitocondrial (ADNmt) ) [6-12].
También se ha informado de que los exosomas pueden ser liberados de múltiples tipos de células, incluidos los reticulocitos [13], inmunocitos, células tumorales y MSC [14]. Esto sugiere que la secreción de exosomas es una función celular general que desempeña un papel importante en la transferencia intercelular de información.
En esta reseña, nos centramos en los mecanismos de exosomas / microvesículas, que cubren el conocimiento actual sobre las características biológicas y sus posibles aplicaciones terapéuticas sin células para los exosomas derivados de MSC.
Caracterización y aislamiento de exosomas.
Los exosomas fueron descubiertos por primera vez por el grupo de Harding como “un cubo de basura” en maduración de reticulocitos de oveja [13]. Originalmente, se pensaba que tenían una morfología típica “en forma de copa” o “similar a un platillo” al analizarse mediante morfología electrónica [15, 16]. El grupo de Zabeo reveló una amplia diversidad en la morfología del exosoma al purificarse a partir de tipos de células homogéneas (la línea de células cebadas humanas HMC-1). Clasificaron la morfología del exosoma en nueve categorías: (1) vesícula única; (2) vesícula doble; (3) vesícula triple o más; (4) vesícula pequeña doble; (5) vesícula ovalada; (6) túbulo pequeño; (7) túbulo grande; (8) vesícula incompleta; y (9) vesícula pleomórfica [17].
Esta categorización sugirió que las diferentes morfologías de los exosomas pueden ir acompañadas de varias funciones específicas. Los exosomas también contienen proteínas de superficie únicas para la ruta endosomal, que generalmente se utilizan para caracterizar los exosomas y distinguirlos de las microvesículas (MV), cuerpos apoptóticos y otras vesículas (Tabla 1), como tetraspaninas (CD63, CD81 y CD9). proteínas de choque térmico (Hsc70), proteínas lisosómicas (Lamp2b), el gen sensible al tumor 101 (Tsg101) y proteínas de fusión (CD9, flotilina y anexina) [12, 18]. Los exosomas se liberan en casi todos los tipos de líquidos extracelulares, incluidos la sangre, la orina, el líquido amniótico, la ascitis, el hidrotórax, la saliva, la leche materna, el líquido seminal y el líquido cefalorraquídeo.
El contenido exosómico depende en gran medida del origen celular. Por ejemplo, los exosomas derivados de los linfocitos B que traen moléculas funcionales coestimuladoras de MHCI, MHCII y células T pueden estimular la proliferación de células T [19]. Además, los exosomas derivados de células cancerígenas contienen enzimas gelatinolíticas y otras moléculas relacionadas con la adhesión celular para ayudar a la progresión tumoral y la metástasis [20].
Es importante destacar que estos exosomas derivados de células cancerígenas se incorporan activamente a las MSC in vitro e in vivo, ya que la transferencia de proteínas exosomales y miRNAs adquiere las características físicas y funcionales de los fibroblastos que soportan tumores [21, 22].
Para obtener más detalles sobre las cargas moleculares y la vía de transmisión de señales extracelulares de los exosomas, el lector puede consultar ExoCarta (http://www.exocarta.org) o EVpedia (http://evpedia.info), así como la Sociedad Americana para exosomas y micro vesículas (http://www.asemv.org), para una exploración a profundidad.
La ultra centrifugación y un kit comercial basado en la precipitación basada en polímeros son los protocolos de purificación mejor establecidos [16]. Otros métodos de aislamiento validados convencionales descritos en la literatura incluyen la ultrafiltración, cromatografía y captura por afinidad [23].
Se han establecido nuevos protocolos para facilitar la fabricación a gran escala y de alta pureza de exosomas. Las técnicas microfluídicas [24] se basan en principios electroquímicos, electromecánicos, visco elásticos [25], ópticos, no ópticos y otros, pero el aislamiento es una población mixta de pequeñas nanopartículas sin mayor demostración de su origen intracelular.
Por lo tanto, utilizamos el término exosomas en esta reseña para referirnos a vesículas extracelulares caracterizadas por marcadores de superficie específicos de exosomas, independientemente de las denominaciones primitivas en los datos publicados.
Cargos y funciones de los exosomas derivados de MSC
La abundancia de cargas identificadas a partir de exosomas derivados de MSC atrae una amplia atención debido a su potencial terapéutico en la reparación de enfermedades cardiovasculares, tejidos (riñón, hígado, piel y córnea), enfermedades inmunes, inhibición de tumores y enfermedades neurológicas.
Funcionan en gran parte a través de la transferencia constante de miRNAs y proteínas, lo que resulta en la alteración de una variedad de actividades en las células diana a través de diferentes vías.
Según ExoCarta, se han recolectado más de 900 especies de proteínas de exosomas derivados de MSC. Salvo algunas proteínas comunes involucradas en el metabolismo celular y el citoesqueleto, se han encontrado muchas proteínas en diferentes fuentes tisulares de exosomas derivados de MSC. Los estudios proteómicos realizados por el grupo de Kang identificaron 103 proteínas de exosomas derivados de células madre neurales. Por ejemplo, la presencia de polimiositis / esclerodermia autoantígeno 2 (PM / Scl2), un auto-antígeno nuclear altamente específico, indica que los exosomas pueden participar en la activación de la autoinmunidad.
También encontraron una imparidad entre los exosomas más grandes que la línea de base (50 nm) y los de morfología más pequeña [26]. Estos hallazgos pueden explicar el fenómeno observado recientemente por Caponnetto et al. respecto a la captación celular de exosomas dependiente del tamaño por las células diana [27]. Curiosamente, todas las enzimas involucradas en la síntesis de glicólisis ATP (gliceraldehído 3-fosfato deshidrogenasa (GAPDH), fosfoglicerato quinasa (PGK), fosfoglucomutasa (PGM), enolasa (ENO) y piruvato quinasa m2 isoforma (PKm2), así como la enzima glucolítica limitante de la velocidad PFKFB3 que regula al alza el fosfofructo quinasa, se identificaron en los exosomas derivados de MSC.
Además, el estrés oxidativo se redujo a través de las peroxirredoxinas y las glutatión S-transferasas en exosomas derivados de MSC [28], lo que sugiere que la reposición de enzimas glucolíticas para aumentar la producción de ATP, así como proteínas adicionales para reducir el estrés oxidativo a través del transporte exosomal, puede ayudar a reducir la muerte celular en lesión por isquemia / reperfusión miocárdica.
También se reportaron niveles comparables de VEGF, inductor de metaloproteinasa de matriz extracelular (EMMPRIN) y MMP-9 en exosomas derivados de MSC. Estas tres proteínas desempeñan un papel importante en la estimulación de la angiogénesis [29], que podría ser fundamental para la reparación de tejidos.
La evidencia experimental reciente resumida por Burrello sugiere que los factores transcripcionales, como Nanog, el factor de transcripción 4 (Oct-4), HoxB4 y Rex-1 de unión al octámero, desempeñan un papel importante en el sistema inmunológico [30]. Por ejemplo, se ha demostrado que HoxB4 afecta la maduración de DC y la proliferación, diferenciación y activación de células T a través de la señalización WNT.
Curiosamente, las proteínas de membrana y los marcadores de superficie específicos de exosomas, como CD81, CD63 y CD9, pueden afectar la respuesta inmune regulando la adhesión celular, la motilidad, la activación y la transducción de señales [31].
Varios estudios también han demostrado que los exosomas derivados de las MSC albergan citoquinas y factores de crecimiento, como el TGFβ1, la interleucina-6 (IL-6), la IL-10 y el factor de crecimiento de hepatocitos (HGF), que han demostrado contribuir a la inmunorregulación [ 30].
miRNAs
Los miRNAs consisten en una clase de pequeños RNAs no codificantes que regulan la expresión génica post transcripcionalmente dirigiéndose a los mRNAs para inducir la supresión de la expresión o escisión de proteínas [32]. Se han encontrado muchos miRNAs en exosomas derivados de MSC y, según se informó, están involucrados en procesos fisiológicos y patológicos, como el desarrollo de organismos, la regulación epigenética, la inmunorregulación, la tumorigénesis y la progresión tumoral.
Notablemente, los exosomas con estructura de membrana actúan como preservadores y liberadores de miRNAs, transfiriendo miRNAs funcionales a las células receptoras. Se ha informado que el exosomal miR-23b, miR-451, miR-223, miR-24, miR-125b, miR-31, miR-214 y miR-122 [33, 34] puede inhibir el crecimiento tumoral y estimular la apoptosis A través de diferentes vías. Por ejemplo, miR-23b promueve la latencia en células de cáncer de mama metastásicas mediante la supresión del gen MARCKS, que codifica una proteína que promueve el ciclo celular y la motilidad [34]. También se ha encontrado que el MiR-16, transportado por exosomas derivados de MSC, suprime la angiogénesis al disminuir la expresión de VEGF en células de cáncer de mama [35].
Recientemente, let-7f, miR-145, miR-199a y miR-221, liberados de los exosomas derivados de MSC umbilical, se ha encontrado que contribuyen en gran medida a la supresión de la replicación del ARN del virus de la hepatitis C (VHC) [36] . El grupo de Di Trapani evaluó los efectos inmunomoduladores ejercidos por los exosomas derivados de MSC en células mononucleares de sangre periférica no fraccionada y en células T, B y NK purificadas.
Ellos observaron que los exosomas tenían niveles más altos de miRNAs en comparación con las MSC y también podían inducir cebado inflamatorio a través de niveles crecientes de miR-155 y miR-146, los cuales son dos miRNAs involucrados en la activación e inhibición de reacciones inflamatorias [37]. Cui et al. también han reportado funciones inmunosupresoras similares en experimentos con animales. [38]. Los exosomas de MSC aumentaron efectivamente el nivel de miR-21 en el cerebro de ratones AD. Además, la reposición de miR-21 restauró los déficits cognitivos en los ratones APP / PS1 y previno las características patológicas regulando las respuestas inflamatorias y restaurando la disfunción sináptica [38]. Estudios recientes también han demostrado que el envejecimiento está sustancialmente controlado por células madre hipotalámicas, parcialmente a través de la liberación de miRNAs exosómicos [39].
Sin embargo, persisten las contradicciones con respecto a estos resultados. Un análisis cuantitativo de la abundancia de miRNA exosomal y la estequiometría por el grupo de Chevillet cuantificó tanto el número de exosomas como el número de moléculas de miRNA en muestras replicadas aisladas de diversas fuentes. Independientemente de la fuente, el estudio indicó que, en promedio, sería necesario examinar más de 100 exosomas para observar una copia de un miRNA abundante, lo que sugiere que la mayoría de los exosomas individuales no tienen un número biológicamente significativo de miRNAs y, por lo tanto, es poco probable que sean funcionalmente individualmente como vehículos para la comunicación basada en miRNA [40].
Otros
En 2006, se reportaron por primera vez los exosomas derivados de MSC que podían modular el fenotipo de las células diana, apoyando la autorrenovación de los progenitores hematopoyéticos y la multipotencia por transferencia de factores de crecimiento y ARNm. Por ejemplo, se encontró que el SOX2 exosomal inicia respuestas innatas contra la infección microbiana a través de la activación de neutrófilos [41]. Aunque los exosomas derivados de MSC tienen la misma morfología que los exosomas de otras células y poseen marcadores típicos, son bastante diferentes en lo que respecta a la compartimentación y la composición de proteínas y ARN.
Por ejemplo, los estudios han indicado que no todos los exosomas derivados de MSC son equivalentes [42]. El grupo de Baglio [6] caracterizó el pequeño RNAoma de los exosomas liberados por el MSC adiposo (ASC) de paso temprano y los MSC de médula ósea (BMSC). Encontraron una gran discrepancia en la proporción de miRNAs en el contenido total de ARN pequeño entre las células (19–49%) y exosomas (2–5%), lo que sugiere que los miRNAs en los exosomas no reflejan simplemente el contenido celular.
Otros estudios con respecto a la sobrerrepresentación del pequeño contenido de ARN-ARNt revelaron un resultado similar. El tRNA más abundante en los exosomas de ASC, tRNA GGC (Gly), representó sólo una pequeña fracción (5%) del total de tRNA celular.
Es importante destacar que los autores también determinaron que las sorprendentes diferencias en las especies de ARNt parecían estar asociadas con el estado de diferenciación de las MSC. Investigaciones recientes han demostrado que la estabilidad de la composición del exosoma es susceptible a las condiciones ambientales localizadas. Por ejemplo, la hipoxia y las señales inflamatorias, como los lipopolisacáridos, pueden ser fuertes factores de interferencia [43].
Exosomas como vehículos de suministro de drogas
Se pueden aplicar características óptimas de vehículos de administración de fármacos para mejorar las cualidades del portador, incluido el tropismo celular, las cargas terapéuticas eficientes, las propiedades fisicoquímicas apropiadas y suficiente tolerancia inmune.
Entre las muchas plataformas de fármacos, los liposomas han sido los vehículos farmacéuticos preferidos para la administración de fármacos. Se ha aprobado una amplia gama de productos de liposomas para el tratamiento de enfermedades, incluidas las infecciones por hongos, el control del dolor, la hepatitis A, la gripe y varios tipos de cáncer [44, 45].
En contraste con los liposomas, los exosomas son óptimos para la administración de fármacos debido a sus propiedades naturales y plasticidad con modificaciones menores. Aquí, comparamos exosomas y liposomas y sugerimos que los exosomas pueden ser prometedoras para la administración de fármacos.
Exosomas versus liposomas
Los exosomas y los liposomas están recubiertos con una membrana de fosfolípido. La estructura de la membrana de los exosomas está incrustada con múltiples biomoléculas naturales, como proteínas de superficie y MHC, mientras que los liposomas pueden modificarse con ligandos dirigidos o moléculas poliméricas inertes como oligosacáridos, glicoproteínas, polisacáridos y polímeros sintéticos [45].
El tamaño de los liposomas está en el rango de 30 nm a varios micrones [46]. Los liposomas más pequeños (tan pequeños como los exosomas) muestran un tiempo de circulación prolongado en comparación con los más grandes, pero la capacidad para una óptima reserva de fármacos y perfiles de liberación se pierde parcialmente.
Para obtener más detalles sobre el tiempo de circulación y la biodistribución, los lectores pueden consultar otras fuentes [46]. Con respecto a las interacciones celulares y la captación, los liposomas pueden estar equipados con ligandos dirigidos, que pueden unirse a receptores u otras moléculas específicas o sobre expresadas por células diana para interacciones y la administración intracelular de fármacos [46].
Sin embargo, la administración de fármacos de los liposomas no es eficiente, ya que muchas modificaciones se han diseñado para minimizar la eliminación y la intoxicación. En general, los liposomas se acumulan en los macrófagos del hígado y el bazo después de la inyección intravenosa. Pocos liposomas están intercalados en otros tejidos, lo que puede deberse a la falta de inmunocompatibilidad. Por otro lado, los exosomas nacen con muchas características de un vehículo ideal de administración de medicamentos.
Por ejemplo, exhiben menor toxicidad en comparación con los liposomas. Además, son bien tolerados por el sistema inmunológico, incluso a través de la barrera hematoencefálica, evitando la fagocitosis o la degradación de los macrófagos [47]. Los exosomas exhiben una tendencia innata a la focalización. Por ejemplo, los exosomas derivados de MSC se alojan preferentemente en tejidos inflamados y tejidos tumorales [48].
Además, los abundantes materiales bioactivos dentro de los exosomas o en la superficie proporcionan un potencial de tratamiento primitivo, y existen abundantes métodos de modificación para la orientación de la membrana y la carga del medicamento.
Alvarez-Erviti et al. diseñaron células dendríticas para expresar Lamp2b, una proteína de membrana exosomal, fusionadas con el péptido RVG específico de la neurona y cargaron estos exosomas modificados con ARNsi mediante electroporación. Estos exosomas inyectados por vía intravenosa mostraron una fuerte caída de BACE1 (ARNm (60%) y proteína (62%)), un objetivo terapéutico de la enfermedad de Alzheimer, en ratones de tipo salvaje [49].
Modificación Exosomal y Carga
Para amplificar los efectos terapéuticos, muchos estudios intentan modificar y cargar diversos factores de tratamiento en los exosomas a través de diversos métodos. Hasta la fecha, estos métodos pueden clasificarse en dos categorías: (1) carga después del aislamiento y (2) carga de exosomas durante la biogénesis.
El primer enfoque se ha aplicado para cargar agentes quimioterapéuticos, ARNsi y miARN. Para reducir la inmunogenicidad y la toxicidad de la doxorubicina, el grupo de Tian facilitó la selección del tumor exosomal mediante la ingeniería de células dendríticas inmaduras de ratón (imDC) para expresar una proteína de membrana exosomal bien caracterizada (Lamp2b) fusionada a un péptido iRGD específico del cáncer de mama (CRGDKGPDC). Los agentes quimioterapéuticos se cargaron mediante electroporación.
Los resultados mostraron una eficacia de encapsulación de hasta el 20% y la doxorrubicina administrada por exosomas específica para las células de cáncer de mama in vitro, lo que llevó a una fuerte actividad antiproliferativa sin toxicidad después de la inyección intravenosa de ratones desnudos BALB / c [50]. Para el ácido nucleico, el método de electroporación también ha sido el de primer orden utilizado en varios estudios [49, 51]. Aunque estos estudios proporcionaron resultados positivos, los debates continúan. Algunos estudios indican que la encapsulación de siRNA es una ilusión causada por la formación de agregados inespecíficos, independientemente de los exosomas. Además, no se pudo medir una encapsulación significativa de siRNA cuando se bloqueó la formación de agregados [52]. Por lo tanto, es necesario establecer múltiples protocolos para cargar exosomas con ácido nucleico.
El segundo enfoque se basa en métodos de transfección para empaquetar proteínas activas, ácido nucleico y otras moléculas activas en exosomas, donde las células se transfectan con un vector diseñado por ingeniería de expresión efector. El grupo de Liu utilizó este método para cargar células con el siRNA del receptor de opioides Mu (MOR) para tratar la adicción a las drogas a través de la reducción de la expresión de MOR, el principal objetivo de los analgésicos opioides utilizados clínicamente, incluida la morfina, el fentanilo y la metadona.
Este nuevo estudio proporcionó una nueva estrategia para el tratamiento de la drogadicción [53]. De manera similar, los oligonucleótidos de ARN sintetizados se transfirieron a MSC para producir exosomas ricos en miR-143, inhibiendo el potencial migratorio de las células de osteosarcoma [54]. Akt se transfectan en MSC derivadas de cordón umbilical utilizando un sistema de transfección de adenovirus que mejoró la función cardíaca en animales tratados con exosomas modificados [55]. Además, Pascucci informó que las MSC pueden adquirir fuertes propiedades anti tumorales después de la incubación con paclitaxel (PTX), incluida la captación de dosis altas de fármacos seguidas de la liberación en exosomas, lo que inhibe la actividad de crecimiento tumoral.
Este método ofrece la posibilidad de utilizar MSC para el desarrollo de fármacos con una especificidad de objetivo celular mayor [56]. Sterzenbach informó el uso de la vía de dominio tardío (dominio L) conservada evolutivamente como un mecanismo para cargar proteínas exógenas en los exosomas [57]. Ellos etiquetaron una proteína diana intracelular con una etiqueta WW, que fue reconocida por los motivos del dominio L en Ndfip1, lo que resultó en la carga de la proteína diana en los exosomas.
Muchos grupos intentaron recientemente la modificación de la superficie de los exosomas para la detección de tejidos y un mayor efecto terapéutico exosómico utilizando técnicas de transfección de genes.
El método convencional para la carga de proteínas en la superficie fue la expresión de una fusión genética entre el péptido objetivo y una proteína que se localiza de forma nativa en la superficie exosomal, como Lamp2 [50]. De manera similar, Ohno y sus colegas diseñaron células donantes para expresar el dominio transmembrana del receptor del factor de crecimiento derivado de las plaquetas fusionado con el péptido GE11, que administró de manera eficiente el miRNA de let-7a al receptor del factor de crecimiento epidérmico (EGFR-) que expresa células de cáncer de mama [58] .
Además, Tamura modificó la superficie exosomal mediante una sencilla mezcla de exosomas originales y pullulan cationizado a través de una interacción electrostática de ambas sustancias, dirigiéndose así al tejido hepático lesionado y aumentando los efectos terapéuticos [59].
El destino de las cargas de ácido nucleico en las células diana sigue siendo controvertido. Por ejemplo, Kanada et al. sugiere que los exosomas no pueden suministrar ácidos nucleicos funcionales a las células diana mediante la detección de destinos diferenciales de biomoléculas cargadas de transfección (ADN plasmídico (pDNA), mRNA y siRNA) administrados a las células diana [60].
MSC como una fuente ideal de exosomas para la administración de medicamentos
Independientemente del hecho de que las propiedades de los exosomas naturales derivados de MSC están disputadas y son distintivas de diferentes orígenes, el uso de exosomas derivados de MSC se ha confirmado para la selección del tipo de célula específica del suministro de fármacos como una mejor alternativa debido a varias características.
Primero, los exosomas no provocan un rechazo inmune agudo, y no hay riesgo de formación de tumores [61]. En segundo lugar, las MSC son productores en masa eficientes de exosomas, que pueden fabricarse a gran escala en cultivo [62], proporcionando apoyo para la terapia individualizada.
En tercer lugar, la seguridad de los exosomas ha sido confirmada in vivo por diferentes modelos de animales [63, 64]. Para lograr la administración de fármacos específicos para cada célula, varios estudios han probado células de donante, métodos de carga y cargas terapéuticas de exosomas derivados de MSC. Las células madre de la médula ósea se utilizan típicamente como células donantes, y los miRNAs se usan típicamente para cargas terapéuticas (Tabla 2).
Un grupo en Egipto también ha procesado un estudio de fase II-III con la hipótesis de que la infusión intravenosa de microvesículas MSC derivadas de sangre de cordón umbilical libre de células podría reducir el estado inflamatorio, mejorando así la masa de células β y el control glucémico en pacientes. con diabetes tipo 1 (T1DM). Sin embargo, estos resultados siguen siendo controvertidos, particularmente en referencia a las respuestas de dosis. Los datos reportados en varios estudios dependen en gran medida de la carga de drogas de los exosomas, no de la cantidad de exosomas.
Exosomas para terapia libre de células
Actualmente, está en marcha el uso de exosomas como herramientas de diagnóstico temprano para varios tipos de cáncer. Además, el uso de exosomas como diagnóstico para el cáncer de próstata está siendo sometido a pruebas aprobadas por la FDA. Si bien las complejidades que rodean el potencial terapéutico de los exosomas continúan desentrenándose, varios ensayos clínicos (Tabla 3, datos de http://clinicaltrials.gov) se han completado o están en curso para evaluar este potencial terapéutico. En estos ensayos, se utilizaron exosomas muy modificados en lugar de exosomas nativos.
Conclusión y perspectiva
El potencial terapéutico de los exosomas presenta nuevas y emocionantes vías para la intervención en muchas enfermedades. El instinto de habilidad para transportar mensajes genéticos y proteger los cargos a las células receptoras preferenciales naturales ha atraído un rápido incremento de interés. Por lo tanto, se han establecido revistas especializadas y sitios web para difundir y desentrañar esta información.
Si bien se están realizando varios ensayos clínicos para evaluar la seguridad y la eficacia de los exosomas como objetivos terapéuticos, aún quedan muchos problemas por resolver. Las preguntas con respecto a cómo producir exosomas de grado clínico en cantidad y cómo varias estrategias de carga y aislamiento afectan la potencia de la administración de fármacos basada en el exosoma siguen sin respuesta.
Por lo tanto, existe una necesidad urgente de examinar detenidamente los siguientes aspectos de los exosomas: (1) potencial terapéutico natural; (2) mecanismo de biogénesis; y (3) cinética de circulación y biodistribución. Aún queda un largo camino por recorrer, desde prometedoras observaciones fenomenológicas hasta aplicaciones clínicas.
Referencias
- C. Toma, W. R. Wagner, S. Bowry, A. Schwartz, and F. Villanueva, “Fate of culture-expanded mesenchymal stem cells in the microvasculature: in vivo observations of cell kinetics,” Circulation Research, vol. 104, no. 3, pp. 398–402, 2009. View at Publisher · View at Google Scholar · View at Scopus
- A. M. Katsha, S. Ohkouchi, H. Xin et al., “Paracrine factors of multipotent stromal cells ameliorate lung injury in an elastase-induced emphysema model,” Molecular Therapy, vol. 19, no. 1, pp. 196–203, 2011.View at Publisher · View at Google Scholar · View at Scopus
- R. H. Lee, A. A. Pulin, M. J. Seo et al., “Intravenous hMSCs improve myocardial infarction in mice because cells embolized in lung are activated to secrete the anti-inflammatory protein TSG-6,” Cell Stem Cell, vol. 5, no. 1, pp. 54–63, 2009. View at Publisher · View at Google Scholar · View at Scopus
- J. L. Spees, R. H. Lee, and C. A. Gregory, “Mechanisms of mesenchymal stem/stromal cell function,” Stem Cell Research & Therapy, vol. 7, no. 1, p. 125, 2016. View at Publisher · View at Google Scholar · View at Scopus
- M. Tkach and C. Thery, “Communication by extracellular vesicles: where we are and where we need to go,” Cell, vol. 164, no. 6, pp. 1226–1232, 2016. View at Publisher · View at Google Scholar · View at Scopus
- S. R. Baglio, K. Rooijers, D. Koppers-Lalic et al., “Human bone marrow- and adipose-mesenchymal stem cells secrete exosomes enriched in distinctive miRNA and tRNA species,” Stem Cell Research & Therapy, vol. 6, no. 1, p. 127, 2015. View at Publisher · View at Google Scholar · View at Scopus
- S. Keerthikumar, D. Chisanga, D. Ariyaratne et al., “ExoCarta: a web-based compendium of exosomal cargo,” Journal of Molecular Biology, vol. 428, no. 4, pp. 688–692, 2016. View at Publisher · View at Google Scholar · View at Scopus
- T. Skotland, K. Sandvig, and A. Llorente, “Lipids in exosomes: current knowledge and the way forward,” Progress in Lipid Research, vol. 66, pp. 30–41, 2017. View at Publisher · View at Google Scholar
- Y. Sato-Kuwabara, S. A. Melo, F. A. Soares, and G. A. Calin, “The fusion of two worlds: non-coding RNAs and extracellular vesicles – diagnostic and therapeutic implications (review),” International Journal of Oncology, vol. 46, no. 1, pp. 17–27, 2015. View at Publisher · View at Google Scholar · View at Scopus
- B. K. Thakur, H. Zhang, A. Becker et al., “Double-stranded DNA in exosomes: a novel biomarker in cancer detection,” Cell Research, vol. 24, no. 6, pp. 766–769, 2014. View at Publisher · View at Google Scholar · View at Scopus
- M. Guescini, S. Genedani, V. Stocchi, and L. F. Agnati, “Astrocytes and glioblastoma cells release exosomes carrying mtDNA,” Journal of Neural Transmission, vol. 117, no. 1, pp. 1–4, 2010. View at Publisher · View at Google Scholar · View at Scopus
- C. Kahlert, S. A. Melo, A. Protopopov et al., “Identification of double-stranded genomic DNA spanning all chromosomes with mutated KRAS and p53 DNA in the serum exosomes of patients with pancreatic cancer,” The Journal of Biological Chemistry, vol. 289, no. 7, pp. 3869–3875, 2014. View at Publisher ·View at Google Scholar · View at Scopus
- C. Harding, J. Heuser, and P. Stahl, “Receptor-mediated endocytosis of transferrin and recycling of the transferrin receptor in rat reticulocytes,” The Journal of Cell Biology, vol. 97, no. 2, pp. 329–339, 1983.View at Publisher · View at Google Scholar
- R. C. Lai, R. W. Y. Yeo, K. H. Tan, and S. K. Lim, “Exosomes for drug delivery—a novel application for the mesenchymal stem cell,” Biotechnology Advances, vol. 31, no. 5, pp. 543–551, 2013. View at Publisher ·View at Google Scholar · View at Scopus
- C. Yang and P. D. Robbins, “The roles of tumor-derived exosomes in cancer pathogenesis,” Clinical and Developmental Immunology, vol. 2011, Article ID 842849, 11 pages, 2011. View at Publisher · View at Google Scholar · View at Scopus
- C. Thery, S. Amigorena, G. Raposo, and A. Clayton, “Isolation and characterization of exosomes from cell culture supernatants and biological fluids,” Current Protocols in Cell Biology, 2006, Chapter 3, Unit 3 22. View at Publisher · View at Google Scholar
- D. Zabeo, A. Cvjetkovic, C. Lasser, M. Schorb, J. Lotvall, and J. L. Hoog, “Exosomes purified from a single cell type have diverse morphology,” Journal of Extracellular Vesicles, vol. 6, no. 1, article 1329476, 2017. View at Publisher · View at Google Scholar
- E. van der Pol, A. N. Boing, P. Harrison, A. Sturk, and R. Nieuwland, “Classification, functions, and clinical relevance of extracellular vesicles,” Pharmacological Reviews, vol. 64, no. 3, pp. 676–705, 2012.View at Publisher · View at Google Scholar · View at Scopus
- G. Raposo, H. W. Nijman, W. Stoorvogel et al., “B lymphocytes secrete antigen-presenting vesicles,” The Journal of Experimental Medicine, vol. 183, no. 3, pp. 1161–1172, 1996. View at Publisher · View at Google Scholar · View at Scopus
- P. Gutwein, A. Stoeck, S. Riedle et al., “Cleavage of L1 in exosomes and apoptotic membrane vesicles released from ovarian carcinoma cells,” Clinical Cancer Research, vol. 11, no. 7, pp. 2492–2501, 2005.View at Publisher · View at Google Scholar · View at Scopus
- J. Paggetti, F. Haderk, M. Seiffert et al., “Exosomes released by chronic lymphocytic leukemia cells induce the transition of stromal cells into cancer-associated fibroblasts,” Blood, vol. 126, no. 9, pp. 1106–1117, 2015. View at Publisher · View at Google Scholar · View at Scopus
- J. A. Cho, H. Park, E. H. Lim et al., “Exosomes from ovarian cancer cells induce adipose tissue-derived mesenchymal stem cells to acquire the physical and functional characteristics of tumor-supporting myofibroblasts,” Gynecologic Oncology, vol. 123, no. 2, pp. 379–386, 2011. View at Publisher · View at Google Scholar · View at Scopus
- M. F. Peterson, N. Otoc, J. K. Sethi, A. Gupta, and T. J. Antes, “Integrated systems for exosome investigation,” Methods, vol. 87, pp. 31–45, 2015. View at Publisher · View at Google Scholar · View at Scopus
- S. Gholizadeh, M. Shehata Draz, M. Zarghooni et al., “Microfluidic approaches for isolation, detection, and characterization of extracellular vesicles: current status and future directions,” Biosensors and Bioelectronics, vol. 91, pp. 588–605, 2017. View at Publisher · View at Google Scholar
- C. Liu, J. Guo, F. Tian et al., “Field-free isolation of exosomes from extracellular vesicles by microfluidic viscoelastic flows,” ACS Nano, vol. 11, no. 7, pp. 6968–6976, 2017. View at Publisher · View at Google Scholar
- D. Kang, S. Oh, S. M. Ahn, B. H. Lee, and M. H. Moon, “Proteomic analysis of exosomes from human neural stem cells by flow field-flow fractionation and nanoflow liquid chromatography-tandem mass spectrometry,” Journal of Proteome Research, vol. 7, no. 8, pp. 3475–3480, 2008. View at Publisher · View at Google Scholar · View at Scopus
- F. Caponnetto, I. Manini, M. Skrap et al., “Size-dependent cellular uptake of exosomes,” Nanomedicine, vol. 13, no. 3, pp. 1011–1020, 2017. View at Publisher · View at Google Scholar
- F. Arslan, R. C. Lai, M. B. Smeets et al., “Mesenchymal stem cell-derived exosomes increase ATP levels, decrease oxidative stress and activate PI3K/Akt pathway to enhance myocardial viability and prevent adverse remodeling after myocardial ischemia/reperfusion injury,” Stem Cell Research, vol. 10, no. 3, pp. 301–312, 2013. View at Publisher · View at Google Scholar · View at Scopus
- K. R. Vrijsen, J. A. Maring, S. A. J. Chamuleau et al., “Exosomes from cardiomyocyte progenitor cells and mesenchymal stem cells stimulate angiogenesis via EMMPRIN,” Advanced Healthcare Materials, vol. 5, no. 19, pp. 2555–2565, 2016. View at Publisher · View at Google Scholar · View at Scopus
- J. Burrello, S. Monticone, C. Gai, Y. Gomez, S. Kholia, and G. Camussi, “Stem cell-derived extracellular vesicles and immune-modulation,” Frontiers in Cell and Developmental Biology, vol. 4, p. 83, 2016. View at Publisher · View at Google Scholar
- S. Levy, S. C. Todd, and H. T. Maecker, “CD81 (TAPA-1): a molecule involved in signal transduction and cell adhesion in the immune system,” Annual Review of Immunology, vol. 16, no. 1, pp. 89–109, 1998.View at Publisher · View at Google Scholar · View at Scopus
- S. Chandra, D. Vimal, D. Sharma, V. Rai, S. C. Gupta, and D. K. Chowdhuri, “Role of miRNAs in development and disease: lessons learnt from small organisms,” Life Sciences, vol. 185, pp. 8–14, 2017.View at Publisher · View at Google Scholar
- V. Fonsato, F. Collino, M. B. Herrera et al., “Human liver stem cell-derived microvesicles inhibit hepatoma growth in SCID mice by delivering antitumor microRNAs,” Stem Cells, vol. 30, no. 9, pp. 1985–1998, 2012. View at Publisher · View at Google Scholar · View at Scopus
- M. Ono, N. Kosaka, N. Tominaga et al., “Exosomes from bone marrow mesenchymal stem cells contain a microRNA that promotes dormancy in metastatic breast cancer cells,” Science Signaling, vol. 7, no. 332, article ra63, 2014. View at Publisher · View at Google Scholar · View at Scopus
- J. K. Lee, S. R. Park, B. K. Jung et al., “Exosomes derived from mesenchymal stem cells suppress angiogenesis by down-regulating VEGF expression in breast cancer cells,” PLoS One, vol. 8, no. 12, article e84256, 2013. View at Publisher · View at Google Scholar · View at Scopus
- X. Qian, C. Xu, S. Fang et al., “Exosomal microRNAs derived from umbilical mesenchymal stem cells inhibit hepatitis C virus infection,” Stem Cells Translational Medicine, vol. 5, no. 9, pp. 1190–1203, 2016.View at Publisher · View at Google Scholar · View at Scopus
- M. Di Trapani, G. Bassi, M. Midolo et al., “Differential and transferable modulatory effects of mesenchymal stromal cell-derived extracellular vesicles on T, B and NK cell functions,” Scientific Reports, vol. 6, no. 1, article 24120, 2016. View at Publisher · View at Google Scholar · View at Scopus
- G. H. Cui, J. Wu, F. F. Mou et al., “Exosomes derived from hypoxia-preconditioned mesenchymal stromal cells ameliorate cognitive decline by rescuing synaptic dysfunction and regulating inflammatory responses in APP/PS1 mice,” The FASEB Journal, 2017. View at Publisher · View at Google Scholar
- Y. Zhang, M. S. Kim, B. Jia et al., “Hypothalamic stem cells control ageing speed partly through exosomal miRNAs,” Nature, vol. 548, no. 7665, pp. 52–57, 2017. View at Publisher · View at Google Scholar
- J. R. Chevillet, Q. Kang, I. K. Ruf et al., “Quantitative and stoichiometric analysis of the microRNA content of exosomes,” Proceedings of the National Academy of Sciences of the United States of America, vol. 111, no. 41, pp. 14888–14893, 2014. View at Publisher · View at Google Scholar · View at Scopus
- P. Xia, S. Wang, B. Ye et al., “Sox2 functions as a sequence-specific DNA sensor in neutrophils to initiate innate immunity against microbial infection,” Nature Immunology, vol. 16, no. 4, pp. 366–375, 2015.View at Publisher · View at Google Scholar · View at Scopus
- D. G. Phinney and M. F. Pittenger, “Concise review: MSC-derived exosomes for cell-free therapy,” Stem Cells, vol. 35, no. 4, pp. 851–858, 2017. View at Publisher · View at Google Scholar
- C. Lo Sicco, D. Reverberi, C. Balbi et al., “Mesenchymal stem cell-derived extracellular vesicles as mediators of anti-inflammatory effects: endorsement of macrophage polarization,” Stem Cells Translational Medicine, vol. 6, no. 3, pp. 1018–1028, 2017. View at Publisher · View at Google Scholar
- H. Xing, K. Hwang, and Y. Lu, “Recent developments of liposomes as nanocarriers for theranostic applications,” Theranostics, vol. 6, no. 9, pp. 1336–1352, 2016. View at Publisher · View at Google Scholar· View at Scopus
- L. M. Mu, R. J. Ju, R. Liu et al., “Dual-functional drug liposomes in treatment of resistant cancers,” Advanced Drug Delivery Reviews, vol. 115, pp. 46–56, 2017. View at Publisher · View at Google Scholar
- R. van der Meel, M. H. Fens, P. Vader, W. W. van Solinge, O. Eniola-Adefeso, and R. M. Schiffelers, “Extracellular vesicles as drug delivery systems: lessons from the liposome field,” Journal of Controlled Release, vol. 195, pp. 72–85, 2014. View at Publisher · View at Google Scholar · View at Scopus
- X. Zhuang, X. Xiang, W. Grizzle et al., “Treatment of brain inflammatory diseases by delivering exosome encapsulated anti-inflammatory drugs from the nasal region to the brain,” Molecular Therapy, vol. 19, no. 10, pp. 1769–1779, 2011. View at Publisher · View at Google Scholar · View at Scopus
- B. Yu, X. Zhang, and X. Li, “Exosomes derived from mesenchymal stem cells,” International Journal of Molecular Sciences, vol. 15, no. 3, pp. 4142–4157, 2014. View at Publisher · View at Google Scholar · View at Scopus
- L. Alvarez-Erviti, Y. Seow, H. Yin, C. Betts, S. Lakhal, and M. J. A. Wood, “Delivery of siRNA to the mouse brain by systemic injection of targeted exosomes,” Nature Biotechnology, vol. 29, no. 4, pp. 341–345, 2011. View at Publisher · View at Google Scholar · View at Scopus
- Y. Tian, S. Li, J. Song et al., “A doxorubicin delivery platform using engineered natural membrane vesicle exosomes for targeted tumor therapy,” Biomaterials, vol. 35, no. 7, pp. 2383–2390, 2014. View at Publisher · View at Google Scholar · View at Scopus
- J. Wahlgren, T. D. L. Karlson, M. Brisslert et al., “Plasma exosomes can deliver exogenous short interfering RNA to monocytes and lymphocytes,” Nucleic Acids Research, vol. 40, no. 17, article e130, 2012. View at Publisher · View at Google Scholar · View at Scopus
- P. Vader, S. A. A. Kooijmans, S. Stremersch, and K. Raemdonck, “New considerations in the preparation of nucleic acid-loaded extracellular vesicles,” Therapeutic Delivery, vol. 5, no. 2, pp. 105–107, 2014. View at Publisher · View at Google Scholar · View at Scopus
- Y. Liu, D. Li, Z. Liu et al., “Targeted exosome-mediated delivery of opioid receptor Mu siRNA for the treatment of morphine relapse,” Scientific Reports, vol. 5, no. 1, article 17543, 2015. View at Publisher ·View at Google Scholar · View at Scopus
- K. Shimbo, S. Miyaki, H. Ishitobi et al., “Exosome-formed synthetic microRNA-143 is transferred to osteosarcoma cells and inhibits their migration,” Biochemical and Biophysical Research Communications, vol. 445, no. 2, pp. 381–387, 2014. View at Publisher · View at Google Scholar · View at Scopus
- J. Ma, Y. Zhao, L. Sun et al., “Exosomes derived from Akt-modified human umbilical cord mesenchymal stem cells improve cardiac regeneration and promote angiogenesis via activating platelet-derived growth factor D,” Stem Cells Translational Medicine, vol. 6, no. 1, pp. 51–59, 2017. View at Publisher · View at Google Scholar
- L. Pascucci, V. Cocce, A. Bonomi et al., “Paclitaxel is incorporated by mesenchymal stromal cells and released in exosomes that inhibit in vitro tumor growth: a new approach for drug delivery,” Journal of Controlled Release, vol. 192, pp. 262–270, 2014. View at Publisher · View at Google Scholar · View at Scopus
- U. Sterzenbach, U. Putz, L. H. Low, J. Silke, S. S. Tan, and J. Howitt, “Engineered exosomes as vehicles for biologically active proteins,” Molecular Therapy, vol. 25, no. 6, pp. 1269–1278, 2017. View at Publisher ·View at Google Scholar
- S. Ohno, M. Takanashi, K. Sudo et al., “Systemically injected exosomes targeted to EGFR deliver antitumor microRNA to breast cancer cells,” Molecular Therapy, vol. 21, no. 1, pp. 185–191, 2013. View at Publisher · View at Google Scholar · View at Scopus
- R. Tamura, S. Uemoto, and Y. Tabata, “Augmented liver targeting of exosomes by surface modification with cationized pullulan,” Acta Biomaterialia, vol. 57, pp. 274–284, 2017. View at Publisher · View at Google Scholar
- M. Kanada, M. H. Bachmann, J. W. Hardy et al., “Differential fates of biomolecules delivered to target cells via extracellular vesicles,” Proceedings of the National Academy of Sciences of the United States of America, vol. 112, pp. E1433–E1442, 2015. View at Publisher · View at Google Scholar · View at Scopus
- T. Chen, F. Arslan, Y. Yin et al., “Enabling a robust scalable manufacturing process for therapeutic exosomes through oncogenic immortalization of human ESC-derived MSCs,” Journal of Translational Medicine, vol. 9, no. 1, p. 47, 2011. View at Publisher · View at Google Scholar · View at Scopus
- R. W. Y. Yeo, R. C. Lai, B. Zhang et al., “Mesenchymal stem cell: an efficient mass producer of exosomes for drug delivery,” Advanced Drug Delivery Reviews, vol. 65, no. 3, pp. 336–341, 2013. View at Publisher ·View at Google Scholar · View at Scopus
- L. Sun, R. Xu, X. Sun et al., “Safety evaluation of exosomes derived from human umbilical cord mesenchymal stromal cell,” Cytotherapy, vol. 18, no. 3, pp. 413–422, 2016. View at Publisher · View at Google Scholar · View at Scopus
- R. Munagala, F. Aqil, J. Jeyabalan, and R. C. Gupta, “Bovine milk-derived exosomes for drug delivery,” Cancer Letters, vol. 371, no. 1, pp. 48–61, 2016. View at Publisher · View at Google Scholar · View at Scopus
- M. Katakowski, B. Buller, X. Zheng et al., “Exosomes from marrow stromal cells expressing miR-146b inhibit glioma growth,” Cancer Letters, vol. 335, no. 1, pp. 201–204, 2013. View at Publisher · View at Google Scholar · View at Scopus
- S. Wu, G. Q. Ju, T. Du, Y. J. Zhu, and G. H. Liu, “Microvesicles derived from human umbilical cord Wharton’s jelly mesenchymal stem cells attenuate bladder tumor cell growth in vitro and in vivo,” PLoS One, vol. 8, no. 4, article e61366, 2013. View at Publisher · View at Google Scholar · View at Scopus
- W. Zhu, L. Huang, Y. Li et al., “Exosomes derived from human bone marrow mesenchymal stem cells promote tumor growth in vivo,” Cancer Letters, vol. 315, no. 1, pp. 28–37, 2012. View at Publisher · View at Google Scholar · View at Scopus
- Q. Long, D. Upadhya, B. Hattiangady et al., “Intranasal MSC-derived A1-exosomes ease inflammation, and prevent abnormal neurogenesis and memory dysfunction after status epilepticus,” Proceedings of the National Academy of Sciences of the United States of America, vol. 114, no. 17, pp. E3536–E3545, 2017.View at Publisher · View at Google Scholar
- K. Drommelschmidt, M. Serdar, I. Bendix et al., “Mesenchymal stem cell-derived extracellular vesicles ameliorate inflammation-induced preterm brain injury,” Brain, Behavior, and Immunity, vol. 60, pp. 220–232, 2017. View at Publisher · View at Google Scholar
- M. Monguio-Tortajada, S. Roura, C. Galvez-Monton et al., “Nanosized UCMSC-derived extracellular vesicles but not conditioned medium exclusively inhibit the inflammatory response of stimulated T cells: implications for nanomedicine,” Theranostics, vol. 7, no. 2, pp. 270–284, 2017. View at Publisher · View at Google Scholar
- S. A. Bliss, G. Sinha, O. A. Sandiford et al., “Mesenchymal stem cell-derived exosomes stimulate cycling quiescence and early breast cancer dormancy in bone marrow,” Cancer Research, vol. 76, no. 19, pp. 5832–5844, 2016. View at Publisher · View at Google Scholar · View at Scopus
- S. Bruno, F. Collino, M. C. Deregibus, C. Grange, C. Tetta, and G. Camussi, “Microvesicles derived from human bone marrow mesenchymal stem cells inhibit tumor growth,” Stem Cells and Development, vol. 22, no. 5, pp. 758–771, 2013. View at Publisher · View at Google Scholar · View at Scopus